
Tripanosomiasis americana (enfermedad de Chagas)
Fecha de actualización: 11/11/2022
(V.2.0/2022)
La enfermedad de Chagas (EC), también conocida como Tripanosomiasis americana, es una parasitosis causada por el protozoo hemoflagelado Trypanosoma cruzi. Es endémica en 21 países de América Central y Sudamérica (según datos de la OMS), en el área comprendida entre México y Argentina (exceptuando las islas del Caribe); aunque debido a los movimientos migratorios que se han producido en las últimas décadas en todo el mundo, la enfermedad actualmente puede ser diagnosticada en cualquier país, principalmente de Norteamérica y Europa.
Se estima que unos 6-7 millones de personas están infectadas de forma global en el mundo, y se diagnostican aproximadamente 30 mil casos nuevos anuales (OMS), por todas las formas de transmisión. Se producen un promedio de 12.000 muertes al año y aproximadamente unos 8.600 recién nacidos (RN) nacen al año con la enfermedad, tras haberse infectado durante la gestación. Dentro de Europa, España es el país con mayor número de personas con EC, siendo aquellas originarias de Bolivia las que representan la mayoría de los casos, alcanzando el 81% del total.
Se puede transmitir por: a) vía vectorial: tras la picadura de un insecto de la familia de los triatominos (conocido como chinche “del beso”, vinchuca, chipo o chiribico según las localizaciones geográficas), produciéndose el paso a la sangre del parásito por el rascado de la piel b) transfusión o trasplante de órganos; c) vía vertical, desde la mujer embarazada a su hijo (vía de transmisión principal en nuestro medio y el resto de áreas no endémicas); y d) vía oral (alimentos contaminados con las heces de los insectos vectores) y accidente de laboratorio; siendo estas dos vías poco frecuentes.
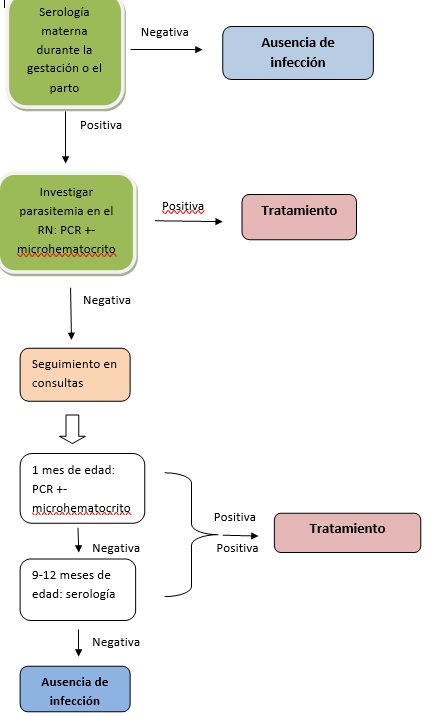
La mujer gestante infectada puede estar asintomática y por tanto desconocer el riesgo de transmisión vertical. Ésta oscila en torno al 2% en áreas no endémicas y alcanza el 4-6% en algunas zonas endémicas1. La enfermedad podría pasar desapercibida durante los primeros años de vida del niño y diagnosticarse ya en fase crónica. Por ello es necesaria la realización del cribado en las embarazadas procedentes de áreas endémicas y el seguimiento posnatal en caso de positividad2.
Es vital descartar la infección congénita en hijos de madre con EC, ya que el tratamiento del niño en estos casos conduce a casi el 100% de curaciones (evitando complicaciones futuras) y presenta menor tasa de reacciones adversas que en edades más tardías.
|
Historia natural de la EC |
|
|
Periodo de incubación |
5-14 días; mayor si transmisión por vía sanguínea. |
|
Fase aguda (1-2 meses) |
|
|
Fase crónica indeterminada (varios años) |
|
|
Fase crónica sintomática (20-30 años después de la fase aguda) Se desarrolla en aproximadamente 1/3 de los casos. |
|
|
Manifestaciones clínicas en el recién nacido |
|
|
Recomendaciones para el control de la transmisión vertical de la EC |
|
|
Mujer embarazada |
Test serológico convencional (CMIA, ELISA o ICT en plasma o suero) + confirmación con otro test convencional (generalmente IFI):
|
|
Recién nacido (sólo en caso de resultado positivo en la madre)6 |
Descartar transmisión vertical mediante:
|
|
Diagnóstico |
|
|
Fase de la enfermedad |
Técnicas diagnósticas |
|
Fase aguda (o los 9-12 primeros meses de vida)7 |
|
|
Fase indeterminada o crónica (o más allá de los 9-12 meses de vida)9 |
|
|
Ver algoritmo más adelante |
|
|
Fármacos para el tratamiento de la EC |
|||||
|
Fármaco |
Vía |
Dosis |
Comentarios |
||
|
Elección |
Benznidazol (Rochagan® o Radanil®) |
Oral |
5-7,5 mg/kg/día10, repartido cada 12 horas (máximo 400mg/día), durante 30-60 días |
|
|
|
Alternativa |
Nifurtimox (Lampid®) |
Oral |
1-16 años |
10-15 mg/kg/día |
|
|
Repartido en 4 dosis, durante 90 días |
|||||
|
|||||
|
Prevención y diagnóstico precoz |
|
|
En zonas endémicas |
|
|
En zonas no endémicas |
|
|
|
| Referencias bibliográficas |
|
Abreviaturas: ELISA: Enzyme-Linked ImmunoSorbent Assay, ensayo por inmunoabsorción ligado a enzimas. IFI: inmunofluorescencia indirecta. ICT: inmunocromatografía de anticuerpos. PCR: reacción en cadena de la polimerasa. TORCH: Toxoplasma, rubéola, citomegalovirus, herpes.
1 Factores de riesgo: haber habitado en casas de adobe, zona rural, contacto con la vinchuca y haber recibido una transfusión sanguínea. Si bien son varios los países americanos afectados por la enfermedad, actualmente las mujeres procedentes de Bolivia constituyen el grupo de mayor riesgo y, por tanto, objeto de las medidas de control descritas aquí.
2 Además del cribado en donantes de sangre y de órganos en personas procedentes de áreas endémicas. Ante la aparición de los primeros casos de Chagas transfusional para asegurar la calidad de la sangre y sus hemoderivados, y evitar el rechazo innecesario de potenciales donantes, se publicó el Real Decreto 1088/2005 , por el que se obliga a los centros de transfusión a realizar la detección serológica de los portadores de T. cruzi en todos los donantes nacidos, o hijos de madres nacidas, o que han sido transfundidos en países donde la enfermedad es endémica.
3 Ya que sólo se produce donde existen vectores que al depositar las heces en el ojo del paciente producen una conjuntivitis química.
4 La aparición de algún signo clínico se ha observado hasta en el 47% de los casos en series bolivianas, si bien son inespecíficos y comunes a las del grupo TORCH, por lo que es preciso sospecharlo para su diagnóstico. Los signos graves se objetivaron en el 27% de los casos, con una mortalidad del 10% en las primeras 48 horas.
5 A realizar en cualquier momento del embarazo o incluso en mismo parto.
6 A todo hijo de madre infectada se le realizará una prueba parasitológica al nacimiento, repetida en el primer mes de vida, y una serología (inmunocromatografía de anticuerpos o ICT) a partir del noveno mes para descartar transmisión vertical.
7 Se debe obtener 1 ml de sangre periférica para realizar la detección del parásito por la técnica del microhematocrito y PCR. En zonas no endémicas podría valorarse realizar únicamente PCR.
8 El MicroStrout® y el micrométodo o microhematocrito emplean técnicas de concentración. Este último consiste en colocar la sangre en tubos capilares y centrifugarla, buscando los parásitos con el microscopio en la interfase entre los glóbulos rojos y blancos. Requiere la participación de un microbiólogo.
9 A partir del 9º-12º meses de edad, 2 serologías positivas son diagnósticas en niños (siempre que no haya descenso de títulos) o una PCR positiva (confirmada en una segunda determinación) a cualquier edad. El protocolo se inicia con un test de ICT+ en la madre, aunque la confirmación en la misma se establece con una segunda técnica serológica. La PCR también es diagnóstica de la enfermedad, aunque en la edad adulta la sensibilidad es menor (dependiendo de las series, alrededor del 60%).
10 La tendencia actual es a emplear de inicio dosis bajas de tratamiento (5mg/Kg/día).
11 La aparición de un síndrome de Stevens-Johnson, aunque poco frecuente, obliga a suspender el tratamiento
| Notas: la Guía-ABE se actualiza periódicamente. Los autores y editores recomiendan aplicar estas recomendaciones con sentido crítico en función de la experiencia del médico, de los condicionantes de cada paciente y del entorno asistencial concreto; así mismo se aconseja consultar también otras fuentes para minimizar la probabilidad de errores. Texto dirigido exclusivamente a profesionales. | |||
|
[i] Más información en:
http://www.guia-abe.es/
[*] Comentarios y sugerencias en: laguiaabe@gmail.com |
Novedades
- Vulvovaginitis
- Bronquiolitis
- Gripe. Pruebas para la detección rápida del virus
- Malaria
- Infección congénita por Citomegalovirus
 Tema nuevo
Tema nuevo  Tema actualizado
Tema actualizado Lo más leído
- Balanitis
- Infecciones de la piel y partes blandas (I): impétigo, celulitis, absceso
- Gastroenteritis aguda
- Faringitis aguda
- Orquiepididimitis aguda








