
Fiebre sin foco en el menor de 3 años
Fecha de actualización: 03/01/2025
(V.2.0/2025)
Se actualizan las escalas de valoración clínica y el algoritmo de evaluación del niño con fiebre sin foco, con la inclusión del Triángulo de Evaluación Pediátrica (TEP) y de la aproximación Paso a paso (“Step by step”). Actualización de la definición de sepsis pediátrica y de las tablas de etiología de FSF y bacteriemia oculta (BO).
|
Definiciones |
|
|
Fiebre |
La fiebre suele definirse por la presencia de una temperatura central superior a 38oC, que se corresponde aproximadamente con una temperatura periférica de 37,5oC1 |
|
Fiebre sin foco (FSF) |
Proceso febril con duración menor a 3-7 días cuyo origen no puede identificarse tras una historia clínica y exploración física minuciosas. No confundir con fiebre de origen desconocido (FOD) (ver “Fiebre de origen desconocido y fiebre prolongada” en Guía ABE) |
|
Bacteriemia oculta (BO) |
Detección de un microorganismo en sangre en un paciente febril con buen estado general y sin un foco de infección evidente |
|
Infección bacteriana potencialmente grave (IBG/IBPG) |
Infección urinaria (ITU), neumonía, meningitis bacteriana, osteomielitis, artritis, celulitis, o enteritis en lactantes menores de 3 meses |
|
Infección bacteriana invasiva (IBI) |
Aislamiento de una bacteria patógena en un líquido estéril (sangre, líquido cefalorraquídeo, pleura, líquido articular) |
|
Disfunción orgánica amenazante para la vida de los sistemas respiratorio, cardiovascular, coagulación y/o nervioso, en un niño con sospecha de infección o infección confirmada. Para objetivar dicha disfunción, desde 2024 se recomienda el uso de la escala de Phoenix, definiéndose la sepsis como: "En pacientes pediátricos con sospecha de infección o infección confirmada, la presencia de al menos 2 puntos en la escala de sepsis pediátrica de Phoenix” |
|
|
Infecciones bacterianas graves (IBG) |
|
|
Infección urinaria (ITU) |
Es la IBG más frecuente en la actualidad, con o sin bacteriemia, siendo su despistaje casi obligado ante aquella FSF en pacientes con antecedentes de ITU o de uropatía, lactantes <6 meses, varones de 6-12 meses con una temperatura ≥ 39ºC o mujeres 6- 24 meses con fiebre ≥ 39ºC
|
|
Bacteriemia oculta (BO) |
Con la introducción de la vacuna PCV, la incidencia de BO se ha reducido del 5% a < 0.5% en nuestro medio y se ha modificado sustancialmente su epidemiología |
|
Neumonía |
La ausencia de tos o signos respiratorios (taquipnea, retracciones costales, saturación O2 < 95 % o auscultación patológica) hace muy improbable el diagnóstico de neumonía oculta. Sin embargo, existe una asociación entre neumonía neumocócica, fiebre elevada y leucocitosis > 20.000/mm3 incluso en ausencia de estos síntomas, por lo que habría que descartarla en estas circunstancias |
|
Meningitis |
Las infecciones meningocócicas pueden cursar como una FSF en las primeras horas a cualquier edad. En menores de 3 meses puede existir meningitis sin signos meníngeos ni otros signos o síntomas neurológicos, siendo recomendable sobre todo en los <21 días la realización de PL incluso en neonatos con buen estado general |
|
Otras: infecciones osteoarticulares o de tejidos blandos, enteritis en menores 3 meses |
Generalmente, puede llegar a determinarse su presencia tras una anamnesis y EF cuidadosas |
|
Etiología de la FSF en menores de 3 meses (España 2016) |
|||
|
Agente etiológico |
Urocultivo n (%) |
Hemocultivo n (%) |
LCR n (%) |
|
Gram negativos |
|||
|
E. coli |
628 (82%) |
46 (46%) |
7 (38,9%) |
|
Klebsiella spp. |
58 (7,6%) |
2 |
|
|
Enterobacter spp. |
16 (2,1%) |
1 |
|
|
Gram positivos |
|||
|
Enterococcus spp |
37 (4,8%) |
5 |
|
|
S. aureus |
5 |
7 (7%) |
2 |
|
S. agalactiae |
3 |
24 (24%) |
3 (16,7%) |
|
S. pneumoniae |
|
6 (6%) |
3 (16,7%) |
|
L. monocytogenes |
9 |
1 |
|
|
Etiología de la bacteriemia oculta de 3 a 36 meses (España, 2018) |
|
S. pneumoniae (79.1 %) |
|
S. aureus (7.5 %) |
|
N. meningitidis B (4.5 %) |
|
E. faecalis (2%) |
|
H. influenza B (3%) |
|
K. kingae (1%) |
|
M. catharralis (1.5%) |
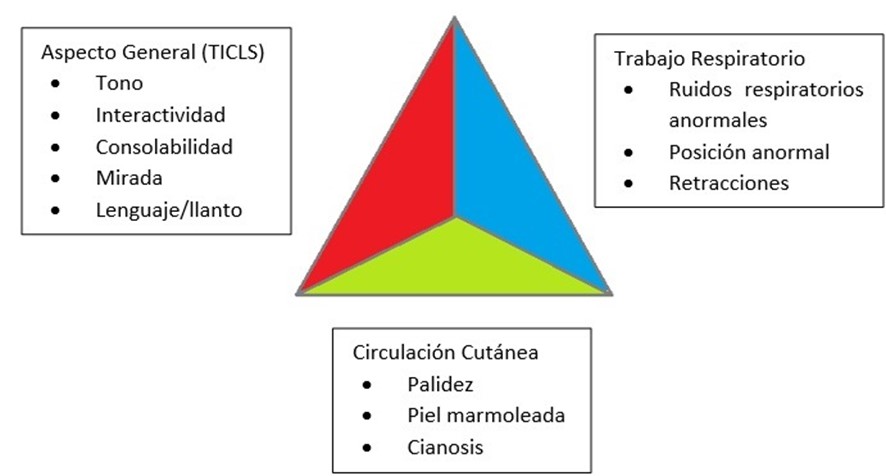
Triángulo de evaluación pediátrica (TEP)
|
Valores de frecuencia cardiaca por edad |
|||
|
Edad (años) |
Normal |
Bradicardia |
Taquicardia |
|
Neonato |
110-160 |
<110 |
>160 |
|
0-1 |
110-160 |
<110 |
>160 |
|
1-2 |
100-150 |
<100 |
>150 |
|
2-3 |
95-140 |
<95 |
>140 |
|
3-5 |
95-140 |
<95 |
>140 |
|
5-6 |
80-120 |
<80 |
>120 |
|
Valores de frecuencia respiratoria por edad |
|||
|
Edad (años) |
Normal |
Bradipnea |
Taquipnea |
|
Neonato |
30-40 |
<30 |
>40 |
|
0-1 |
30-40 |
<30 |
>40 |
|
1-2 |
25-35 |
<25 |
>35 |
|
2-3 |
25-30 |
<25 |
>30 |
|
3-4 |
25-30 |
<25 |
>30 |
|
4-5 |
25-30 |
<25 |
>30 |
|
5-6 |
20-25 |
<20 |
>25 |
|
Datos clave anamnesis y exploración |
|
|
Edad2 |
La probabilidad de presentar una IBG/IBI es mayor en niños menores de 3 meses (3-4%) y sobre todo en menores de 21 días. El riesgo disminuye entre los 3 y 36 meses y a partir de esa edad es muy raro que una IBG se manifieste sin síntomas focales |
|
Estado inmunitario |
Es fundamental valorar si el niño presenta algún defecto de la inmunidad primario o secundario (ej. tratamientos inmunosupresores) y está correctamente vacunado3 |
|
Temperatura |
El riesgo de IBG se incrementa con la temperatura, si bien la correlación entre la magnitud de la fiebre y la bacteriemia no es tan clara en la era post-vacuna neumocócica conjugada4 |
|
Estado general5 |
Como aproximación inicial nos valdremos del Triángulo de Evaluación Pediátrica (TEP)6. Después, se recomienda el uso de escalas clínicas para valorar el riesgo de padecer una IBG. En los últimos años, y teniendo en cuenta la epidemiología de nuestro medio, recomendamos el uso del método “Paso a paso” (Step by step)7 |
|
Constantes vitales |
La toma de constantes, FC y FR, son parámetros que permiten una aproximación más objetiva y no solo basada en el estado general del paciente. Igualmente, el tiempo de relleno capilar orienta sobre la perfusión periférica y se realizará toma de tensión arterial cuando sea posible |
|
Anamnesis dirigida y exploración física (EF) |
Se interrogará y buscarán síntomas y signos de mal estado general que orienten a una IBG que precise una actuación rápida (petequias, meningismo) o de focalidad manifiesta (diarrea sanguinolenta, menor movilidad de alguna articulación, crepitantes…). Los síntomas leves catarrales o deposiciones diarreicas escasas no deben de considerarse como focalidad, especialmente en los de menor edad. En los menores de 21 días habrá que indagar especialmente sobre antecedentes perinatales (EGB materno, presencia de vesículas que orienten a la presencia de herpes simple (VHS)8 |
|
Muestra de orina |
Bolsa colectora para sistemático de orina y, si aparecen leucocituria y/o nitruria, recogida de nueva muestra por técnica estéril para comprobar UA y UC si se confirma. En menores de 21 días se recomienda la recogida de UA y UC por técnica estéril de inicio. Considerar su realización si UA negativo pero PCT ≥, 0,5ng/mL, PCR >20mg/L o neutrófilos >10.000/mm3
|
|
Muestra sanguínea |
Hemograma11, proteína C reactiva (PCR)12 procalcitonina (PCT)13 y hemocultivo. La PCT es la prueba con mayor rendimiento para IBG/IBI (Valor >0.5ng/mL). Le siguen PCR > 20mg/dL y neutrofilia > 10.000/mm3). En caso de sospecha por VHS, determinación de PCR, así como para enterovirus/parechovirus si disponibilidad |
|
Pruebas de diagnóstico rápido de virus influenza |
En época epidémica. Si es positivo, y hay bajo riesgo de IBG, puede obviarse la determinación de pruebas sanguíneas en el >21 días |
|
Líquido cefalorraquídeo (LCR) |
Citoquímica, cultivo y panel de rt-PCR múltiple14 en todos los <21 días y aquellos con riesgo alto de IBG. Considerar en aquellos >21 días de bajo riesgo pero elevación marcada de PCT/PCR, especialmente PCT |
|
Muestra de orina |
Bolsa colectora para sistemático de orina y, en caso de leucocituria y/o nitruria, envío de nueva muestra por técnica estéril para comprobar UA y UC si se confirma17 |
|
Muestra sanguínea |
No indicada de manera rutinaria en lactantes con FSF y bien estado general (bajo riesgo de IBG), por la prevalencia de BO actual. En caso de realizarse18: Hemograma19, PCR20 PCT21 y hemocultivo, hemocultivo y rt-PCR para neumococo y meningococo en caso de disponibilidad. |
|
Pruebas de diagnóstico rápido de virus influenza o SARS-Cov-2 |
En época epidémica. Si es positivo, y hay bajo riesgo de IBG, puede obviarse la determinación de pruebas sanguíneas |
|
Líquido cefalorraquídeo (LCR) |
No practicar de rutina si bajo riesgo de IBG, ausencia de irritabilidad, abombamiento de fontanela o meningismo. Citoquímica, Gram, cultivo y rt-PCR para enterovirus, neumococo y meningococo |
|
Radiografía de tórax (o ecografía si disponibilidad) |
Considerar si leucocitosis ≥ 20.000/mm3 o neutrofilia ≥ 10.000/mm3, especialmente en > 1 año o PCR elevada, por la asociación con neumococo / neumonía oculta |
|
Criterios de bajo riesgo de IBG/IBI en lactantes con FSF (Step by Step) |
|
Buen estado general (TEP normal) |
|
Edad >21 días |
|
No alteraciones en tira de orina |
|
PCT < 0,5 ng/ mL |
|
PCR < 20 mg/l o neutrófilos totales < 10.000/mm3 |
|
Criterios de riesgo de IBG/IBI en lactantes con FSF (Step by Step) |
|
Mal estado general (TEP inestable) |
|
Edad < 21 días |
|
Tira de orina positiva para esterasa leucocitaria |
|
Procalcitonina > 0.5 ng/ml |
|
PCR > 20 mg/l o neutrófilos totales > 10.000/mm3 |
|
Ingreso hospitalario |
|
|
< 21 días |
Siempre |
|
>21 días-2 meses con TEP estable |
Individualizar ingreso hospitalario/unidad de observación en función de la edad, temperatura, parámetros analíticos y contexto higiénico-social del paciente (cercanía a centro hospitalario, nivel de comprensión de los cuidadores…). Se recomienda al menos observación durante las 12 primeras horas de fiebre, ampliándose el margen hasta 24-36 h según algunas guías. |
|
>2 meses con TEP estable |
Considerar si elevación de RFA (PCT ≥ 0,5 ng/mL; leucocitos > 15.000/mm3, neutrófilos > 10.000/mm3).
|
|
TEP inestable |
Siempre |
|
Tratamiento antibiótico empírico |
|
|
TEP INESTABLE |
|
|
< 1 mes |
Ampicilina 75 mg/kg + cefotaxima 50 mg/kg. Valorar asociar aciclovir 20 mg/kg si sospecha de infección por VHS22 |
|
1-3 meses |
Cefotaxima 75 mg/kg (máx. 3 g)23 +/- vancomicina 15 mg/kg (máx. 1 g) si alta prevalencia de S. aureus meticilin resistente o de neumococo resistente a cefalosporinas +/- clindamicina 10 mg/kg (máx. 650 mg) si sospecha clínico-epidemiológica de shock tóxico estreptocócico |
|
>3 meses |
Cefotaxima i.v. 75 mg/kg/dosis (máx. 2 g) |
|
TEP ESTABLE |
|
|
< 1 mes |
Ampicilina (50 mg/kg/8 horas) + gentamicina (4 mg/kg/24 horas)24. Si pleocitosis: Ampicilina (75 mg/kg/6 horas en > 7 días y 100 mg/kg/8 horas en ≤ 7 días) + ceftazidima (50 mg/kg/8 horas) + aciclovir 20 mg/kg/8 horas |
|
1-2 meses sin leucocituria con elevación de RFA (PCT ≥ 0,5 ng/mL; leucocitos > 15.000/mm3, neutrófilos > 10.000/mm3)
|
Ceftriaxona 50 mg/kg (máx. 2 g)25,26 Si pleocitosis Cefotaxima (75 mg/kg/6 horas) + vancomicina (15 mg/kg/6 horas)27 |
|
> 2 meses sin leucocituria con elevación de RFA (PCT ≥ 0,5 ng/mL; leucocitos > 15.000/mm3, neutrófilos > 10.000/mm3)
|
Ceftriaxona 50 mg/kg (máx. 2 g)28,29
|
|
Sospecha de infección urinaria hasta el resultado del cultivo |
Ver capítulo ITU |
|
Sin indicación de ingreso/antibioterapia empírica: Bajo riesgo de IBG |
|
Manejo sintomático de la fiebre. Ver capítulo Fiebre: ¿cómo medir la temperatura?, ¿cuándo y cómo tratar la fiebre? Guía-ABE |
|
Recomendaciones para observación domiciliaria y explicación de signos de alarma ante los que consultar |
| Referencias bibliográficas |
|
Abreviaturas: BO: bacteriemia oculta HSV: virus herpes simple IBPG: Infección bacteriana (potencialmente) grave. IBI: infección bacteriana invasiva FC: frecuencia cardiaca LCR: líquido cefalorraquídeo FR: frecuencia respiratoria FSF: fiebre sin foco RFA: reactantes de fase aguda Rt-PCR: real- time polymerase chain reaction PCR: proteína C-reactiva PCT: procalcitonina PCV: vacuna conjugada frente a neumococo SGB: estreptotoco del grupo B (S. agalactiae) TEP: triángulo de evaluación pediátrico UA urinanálisis UC: urocultivo
1No hay consenso en cuanto al método ideal para medir la temperatura. La temperatura rectal es la que mejor refleja la temperatura central. Se considera la temperatura de referencia, pero es un método invasivo, por lo que en general se recomienda la toma de temperatura axilar mediante un termómetro digital. Los termómetros de infrarrojos, timpánicos o de frente, son menos fiables si no se trata de personal sanitario adiestrado. La apreciación subjetiva de fiebre por parte de los padres se considera fiable.
2El riesgo de presentar una IBI/IBG aumenta de manera inversamente proporcional a la edad del paciente por: inmadurez del sistema inmunológico, no haber recibido todas las inmunizaciones y menor expresividad clínica, dificultando el diagnóstico. Según las series y países, los porcentajes de IBG/IBI pueden variar, pero de manera general se observa que los menores de tres meses tienen mayor riesgo de IBI/IBPG y, dentro de este grupo, el porcentaje aumenta considerablemente en los menores de 21 días. En concreto, en el estudio de la red PECARN (2018) la tasa de bacteriemia en la 4º semana de vida en lactantes con FSF fue de 1.6% comparada con aquellos con 2 semanas de vida (5.3%) y 3 semanas (3.3%)
3Se considera que un niño no está correctamente inmunizado cuando no ha recibido al menos 2 dosis de vacuna conjugada frente a neumococo y H. influenzae b al menos 15 días antes de la consulta. En lactantes de 6-12 semanas que hayan recibido una dosis de vacuna en las 72 horas previas, no hay mayor riesgo de IBG pero sí debe realizarse despistaje de ITU.
4El grado de temperatura suele relacionarse de manera más directa con el neumococo, y menos con otras bacterias. Infecciones bacterianas graves como la infección del tracto urinario (ITU) y la bacteriemia oculta son más frecuentes con temperaturas superiores a 39°C y aunque una fiebre de bajo grado no excluye la posibilidad, sí presenta un valor predictivo negativo de IBG. Es por ello que, con fiebre >40’5ºC, se aconseja la realización de pruebas sanguíneas independientemente del estado vacunal.
5El estado general tiene un valor predictivo alto para predecir enfermedad grave cuando está alterado, pero no ocurre a la inversa, por lo que, sobre todo en menores de 3 meses, pueden existir IBG/IBI con buen estado general. El uso de escalas clínicas puede ayudar a estratificar el riesgo de IBG/IBI y orientar a quién deben realizarse pruebas complementarias para su despistaje.
6El TEP se ha desarrollado como una herramienta de triaje universal en niños que permite una primera impresión clínica “de visu” del paciente sin precisar de ninguna herramienta adicional. Se valoran, usando la vista y el oído, la estabilidad/inestabilidad de los lados de dicho triángulo: apariencia, respiración, circulación).
7El desarrollo de escalas clínicas para estratificar el riesgo de padecer una IBG/IBI y su manejo, con la inclusión de pruebas más o menos invasivas, ha experimentado un gran desarrollo en los últimos años. Las escalas de YIOS y YALE han dado paso a algoritmos basados en el riesgo de padecer una IBG/IBI, como el “Paso a paso”(“Step by step”) o la regla clínica PECARN, que tienen en consideración los cambios epidemiológicos tras la introducción universal de la PCV y las mejoras en la atención perinatal, como el despistaje de SGB en embarazadas.
8Aunque la incidencia de infección herpética por VHS en España parece ser baja, su morbimortalidad e importancia de un tratamiento precoz con aciclovir obligan a estar alerta ante datos que pudieran orientar a su presencia.
9Basadas en el algoritmo “Paso a paso” ( “Step by step”).
10En lactantes <3 meses con FSF, al precisar casi de manera generalizada pruebas complementarias sanguíneas, será preciso derivar al hospital.
11El recuento leucocitario tiene valor como posible marcador de IBG sobre todo para niños incorrectamente vacunados, dada la asociación de bacteriemia oculta por neumococo con cifras de leucocitos totales >15.000/mm3 o neutrófilos totales >10.000/mm3. Sin embargo, tiene una sensibilidad y especificidad limitadas para infecciones por gérmenes como S. aureus, Salmonella spp. y N. meningitidis
12La PCR tarda al menos 12 horas en empezar a elevarse, por lo que tiene poco valor en fiebres de corta evolución. Útil como marcador de infección bacteriana grave si > 80 mg/dl y bajo riesgo si < 20 mg/l.
13La PCT se eleva más precozmente, a las 3 horas. En infecciones víricas no suele superar 0.5 ng/ml y por encima de 2 ng/ml la posibilidad de infección bacteriana es alta.
14Si no disponible, considerar al menos determinación de virus herpes simple, enterovirus y parechovirus.
15Basadas en el algoritmo “Paso a paso” ( “Step by step”).
16En lactantes <3 meses con FSF, al precisar casi de manera generalizada pruebas complementarias sanguíneas, será preciso derivar al hospital.
17Muestra de orina en: todos los < 6 meses o aquellos con patología renal de base o antecedentes de ITU, niñas de 6-24 meses de edad con FSF ≥ 39°C y niños de 6-12 meses de edad con FSF ≥ 39°C. Valorar cuando FSF varios días de evolución independientemente del pico máximo de temperatura y edad.
18Considerar en: < 6 meses y FSF ≥ 39°C, 6-24 meses con FSF ≥ 40,5°C, independientemente de su estado vacunal y 6-24 meses con FSF ≥ 39,5°C que no hayan recibido al menos dos dosis de la vacunación PCV (transcurridas al menos dos semanas desde la segunda).
19El recuento leucocitario tiene valor como posible marcador de IBG sobre todo para niños incorrectamente vacunados, dada la asociación de bacteriemia oculta por neumococo con cifras de leucocitos totales >15.000 o neutrófilos totales >10.000. Sin embargo, tiene una sensibilidad y especificidad limitadas para infecciones por gérmenes como S. aureus, Salmonella spp. y N. meningitidis
20La PCR tarda al menos 12 horas en empezar a elevarse, por lo que tiene poco valor en fiebres de corta evolución. Útil como marcador de infección bacteriana grave si > 80 mg/dl y bajo riesgo si < 20 mg/l.
21La PCT se eleva más precozmente, a las 3 horas. En infecciones víricas no suele superar 0.5 ng/ml y por encima de 2 ng/ml la posibilidad de infección bacteriana es alta.
22Se asocia mayor riesgo de VHS si: 15 días de vida, antecedente de convulsión, mal estado general, trombopenia, exantema vesicular o prematuridad.
23Alérgicos a betalactámicos: aztreonam 30 mg/kg (máx. 2 g).
24Sustituir gentamicina por cefotaxima 50 mg/kg (cada 8 horas en > 7 días y cada 12 horas en ≤ 7 días) si alta tasa de bacterias gentamicina-resistentes, especialmente E. coli
25Alta domiciliaria salvo elevación marcada de la PCT, con pautas de vigilancia y de cuándo consultar en centro hospitalario. Control clínico en 24 horas. Si el paciente tiene buen estado general y el hemocultivo es negativo transcurridas al menos 24 horas, puede discontinuarse el antibiótico.
26Considerar asociar ampicilina (50 mg/kg/6 horas) si alta prevalencia de bacteriemia por Listeria o enterococo
27Considerar asociar ampicilina (75 mg/kg/6 horas) si alta prevalencia de meningitis por Listeria o enterococo
28Alta domiciliaria salvo elevación marcada de la PCT, con pautas de vigilancia y de cuándo consultar en centro hospitalario. Control clínico en 24 horas. Si el paciente tiene buen estado general y el hemocultivo es negativo transcurridas al menos 24 horas, puede discontinuarse el antibiótico.
29Alta domiciliaria salvo elevación marcada de la PCT, con pautas de vigilancia y de cuándo consultar en centro hospitalario. Control clínico en 24 horas. Si el paciente tiene buen estado general y el hemocultivo es negativo transcurridas al menos 24 horas, puede discontinuarse el antibiótico.
| Notas: la Guía-ABE se actualiza periódicamente. Los autores y editores recomiendan aplicar estas recomendaciones con sentido crítico en función de la experiencia del médico, de los condicionantes de cada paciente y del entorno asistencial concreto; así mismo se aconseja consultar también otras fuentes para minimizar la probabilidad de errores. Texto dirigido exclusivamente a profesionales. | |||
|
[i] Más información en:
http://www.guia-abe.es/
[*] Comentarios y sugerencias en: laguiaabe@gmail.com |
Novedades
- Bronquiolitis
- Gripe. Pruebas para la detección rápida del virus
- Malaria
- Gripe
- Infección por Helicobacter pylori
 Tema nuevo
Tema nuevo  Tema actualizado
Tema actualizado Lo más leído
- Balanitis
- Infecciones de la piel y partes blandas (I): impétigo, celulitis, absceso
- Gastroenteritis aguda
- Faringitis aguda
- Orquiepididimitis aguda








