
Mantoux e IGRAs
Fecha de actualización: 22/03/2021
(V.1.0/2021)
- La tuberculosis es, a nivel mundial, una de las enfermedades infecciosas con mayor impacto socio-sanitario. En los pacientes pediátricos, sobre todo en los más pequeños, el diagnóstico de certeza sigue siendo un reto y, a pesar de la aparición de técnicas moleculares que lo mejoran, las técnicas inmunológicas siguen siendo elementos clave.
- Dentro de estas disponemos del Mantoux realizada in vivo y las llamadas Interferón-Gamma Release Assays (IGRAs) realizadas in vitro. Ambas dependen de la inmunorrespuesta celular a los antígenos de las micobacterias
- El Mantoux es la prueba de referencia empleada en el diagnóstico de la infección tuberculosa. Mide la reacción de hipersensibilidad retardada a los múltiples antígenos de las micobacterias contenidos en el PPD (purified protein derivative), por lo que su sensibilidad y especificidad no son suficientemente altas.
- Para su valoración se han definido unos puntos de corte en función de los datos epidemiológicos e individuales que tratan de minimizar estas deficiencias.
- Los IGRAs, incorporados en los últimos años, miden la producción de IFNγ al estímulo de 2 ó 3 antígenos que no tienen reacción cruzada con la mayoría de las micobacterias no tuberculosas (MNT) y por lo tanto tienen una mayor especificidad y pueden superar algunas de las limitaciones del Mantoux.
- Ambos test tienen menor sensibilidad en individuos con la inmunidad celular disminuida, incluidos los niños menores de 5 años.
- La positividad de ambos test se alcanza entre las 6-8 semanas tras la infección (rango 2-12 sem).
| Prueba de la tuberculina (PT)/ Mantoux o Tuberculin skin test (TST) | |
|
|
| Técnica |
|
|
Lectura |
|
|
Interpretación de la prueba |
|
|
Falsos positivos |
|
|
Falsos negativos |
|
|
Complicaciones |
|
|
Observaciones |
|
|
Indicaciones |
|
| Interferón-Gamma ReleaseAssays ( IGRAs) | |
|
|
|
Indicaciones |
|
|
Inconvenientes |
|
|
Ventajas |
|
Comparación entre Mantoux e IGRAs
|
|
Mantoux |
IGRAs |
|
Antígenos incluidos |
Múltiples (>200) |
2-3 |
|
Reacción cruzada |
Si, con BCG y MNT |
Raras. Sólo algunas MNT |
|
Sensibilidad |
55-83% |
52-94% |
|
Especificidad |
70-92% |
90-100% |
|
Coste |
Bajo |
Más elevado |
|
Diferenciación entre infección y enfermedad |
No |
No |
MNT: micobacterias no tuberculosas
Algoritmo combinado o secuencial de Mantoux e IGRA
Existen varias aproximaciones al uso de Mantoux e IGRAs en el diagnóstico de la tuberculosis: el uso de una prueba única, el uso simultaneo de ambas o el uso secuencial. El uso combinado de Mantoux e IGRAs aumenta la sensibilidad diagnóstica por encima del 90%, por lo que, en niños con uno de los tests negativos, podría realizarse secuencialmente el otro, en cualquier situación en la que sea preciso mejorar esa sensibilidad (alta sospecha clínica de tuberculosis, pacientes con especial riesgo de progresión a enfermedad tuberculosa etc).
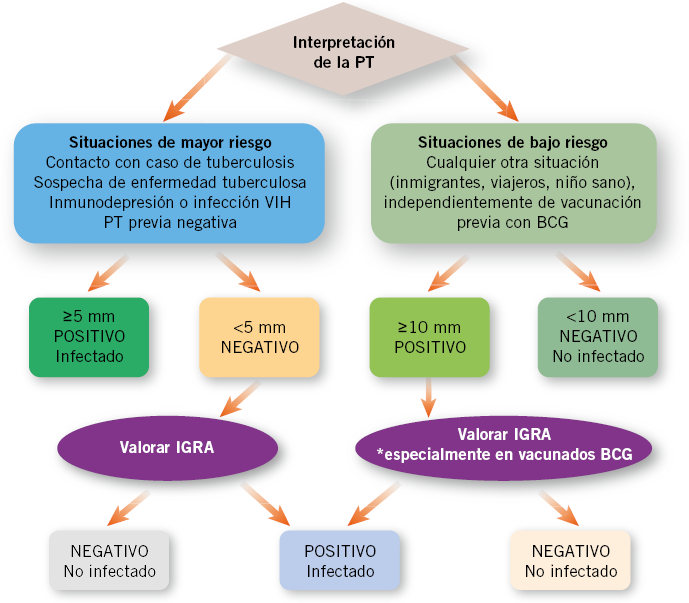
Tomado de: Tuberculosis pulmonar. Méndez Echevarría A, Baquero-Artigao, F. Pediatr Integral 2016; XX (2): 109–118 9 10 11
| Referencias bibliográficas |
|
1Datos epidemiológicos como contacto íntimo con caso índice o sospechoso de enfermedad, e individuales como edad, inmunodepresión o conversión de una prueba previa negativa.
2El PPD fue adoptado por la OMS (1951) como estándar internacional (PPD-S), respecto al cual deben estandarizarse todos los preparados comerciales de PPD (PPD-RT21, PPD-RT23, PPDCT68, etc). El más usado y recomendado por la OMS es el PPD-RT23. Debe conservarse entre 4-8º C y lejos de la exposición solar, ya que fuera de estas condiciones pierde actividad con el tiempo. Debe vehiculizarse en 0.1 cc de disolvente. Numerosos trabajos han establecido que la dosis ideal son 5 UT de PPD-S (equivale biológicamente a 2 UT de PPD-RT23).
3Numerosos expertos recomiendan administrarla en la cara anterolateral del brazo izquierdo, 2 cm por debajo de la flexura del codo. Con ello se evita “marcarlo” y la estigmatización asociada
4Hablamos de conversor cuando detectamos de una induración ≥5 mm en una persona con respuesta negativa a la tuberculina en los dos años previos, si previamente se ha descartado efecto booster)
5Si bien la ficha técnica no recomienda su uso más allá de 24 horas tras la apertura del envase, algunos estudios han demostrado que, en condiciones de conservación adecuadas, puede ser utilizada durante al menos 1 semana. En el año 2014 y, ante una situación de desabastecimiento, la Sociedad Española de Infectología Pediátrica (SEIP), el Comité de Medicamentos de la AEP (CM-AEP) y la Red Española de Estudio de la Tuberculosis Infantil (pTBred) emitieron un informe: (Información y consideraciones ante el desabastecimiento de la tuberculina en Europa) en el que subrayan “ la tuberculina no pierde potencia ni se contamina aunque se mantengan abiertos los viales durante una semana o un mes, conservados adecuadamente, tal y como lo demuestra un estudio español3 realizado en Vigo en el año 2004”.
6 El QuantiFERON-TB Gold Plus (QFT-Plus) es un QFT-GIT de nueva generación. La principal diferencia entre QFT-Plus y QFT-GIT es que QFT-Plus tiene dos tubos recubiertos de antígeno específico de M. tuberculosis, denominados TB1 y TB2. El TB1 contiene los péptidos largos de ESAT-6 y CFP-10, pero no el TB7.7, mientras que el TB2 contiene seis péptidos cortos, además de los mismos componentes del TB1, induciendo así respuestas inmunitarias de células T CD4+ y CD8+.
7Un estudio realizado en nuestro país (Soler-García A et al.) concluye: “Nuestros resultados sugieren que los ensayos QFT-Plus no funcionan mejor que los ensayos QFT-GIT de la generación anterior como prueba complementaria para el diagnóstico de la TB en niños y adolescentes en un entorno de baja carga de TB. QFT-Plus, no puede utilizarse como prueba de exclusión”.
8 Aunque las actuales guías no recomiendan los IGRAs en menores de 5 años e inmunodeprimidos por el aumento de la frecuencia de resultados indeterminados, en base a estudios más recientes el Comité de Enfermedades Infecciosas de la Academia Americana de Pediatría, se ha bajado la edad de uso a los 2 años (2018 Reed Book6) y algunos expertos lo indican en los más pequeños.
9Ante un paciente vacunado de BCG con Mantoux positivo e IGRA negativo, deben de valorarse con prudencia los datos clínicos y epidemiológicos y tratar si existe una sospecha razonable de TB.
10En los últimos años se están investigando nuevos biomarcadores inmunológicos (distintos del interferón-γ) que podrían permitir el desarrollo de mejores pruebas de inmunodiagnóstico de la tuberculosis para niños. Estos biomarcadores incluyen diversas respuestas de citoquinas específicas de las micobacterias que tienen mejores características de rendimiento que el interferón-γ y podrían facilitar simultáneamente la distinción entre la tuberculosis latente y la activa.
11No hay uniformidad de criterio a la hora de priorizar uno u otro test. En países desarrollados se sitúan al mismo nivel o incluso se prioriza el uso de IGRAs en mayores de 5 años. Debe de valorarse en cada medio la accesibilidad y las características del paciente.
| Notas: la Guía-ABE se actualiza periódicamente. Los autores y editores recomiendan aplicar estas recomendaciones con sentido crítico en función de la experiencia del médico, de los condicionantes de cada paciente y del entorno asistencial concreto; así mismo se aconseja consultar también otras fuentes para minimizar la probabilidad de errores. Texto dirigido exclusivamente a profesionales. | |||
|
[i] Más información en:
http://www.guia-abe.es/
[*] Comentarios y sugerencias en: laguiaabe@gmail.com |
Novedades
- Vulvovaginitis
- Bronquiolitis
- Gripe. Pruebas para la detección rápida del virus
- Malaria
- Infección congénita por Citomegalovirus
 Tema nuevo
Tema nuevo  Tema actualizado
Tema actualizado Lo más leído
- Balanitis
- Infecciones de la piel y partes blandas (I): impétigo, celulitis, absceso
- Gastroenteritis aguda
- Faringitis aguda
- Orquiepididimitis aguda








